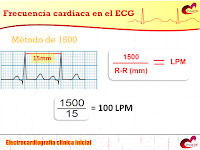
Introducción
El término
endocarditis se referirse a la inflamación del endocardio y en su mayoría de etiología
infecciosa (es decir, una endocarditis infecciosa). Aunque también puede
incluir la endocarditis no infecciosa,
que consiste en la formación de trombos estériles compuestos de plaquetas y
fibrina en las válvulas cardíacas y el endocardio adyacente. En ocasiones, la
endocarditis no infecciosa termina en una infecciosa. Ambas entidades pueden
producir embolias y comprometer la función cardíaca.
El
diagnóstico de la endocarditis infecciosa generalmente se basa en una
constelación de hallazgos clínicos en lugar de en una sola prueba definitiva.
La
endocarditis infecciosa puede aparecer a cualquier edad. Los hombres tienen una
frecuencia 2 veces mayor que las mujeres. Los drogadictos IV, los pacientes
inmunocomprometidos y los pacientes con válvulas cardíacas protésicas y otros
dispositivos intracardíacos tienen mayor riesgo.
Etiología
El
corazón normal es relativamente resistente a las infecciones. Las bacterias y
los hongos no se adhieren fácilmente a la superficie endocárdica y el flujo
sanguíneo constante ayuda a prevenir su asentamiento en las estructuras
endocárdicas. Por lo tanto, habitualmente son necesarios 2 factores para la
endocarditis:
·
Una anormalidad predisponente del endocardio
·
Microorganismos en el torrente sanguíneo (bacteriemia)
Rara
vez, una bacteriemia masiva o la infección por microorganismos particularmente
virulentos causan endocarditis en válvulas normales.
Factores endocárdicos
La endocarditis
suele comprometer las válvulas cardíacas. Los principales factores
predisponentes son las cardiopatías
congénitas, la enfermedad valvular reumática, las
válvulas aórticas bicúspides o calcificadas,
el prolapso de la válvula mitral, la miocardiopatía
hipertrófica y la endocarditis previa. Las prótesis valvulares y otros
dispositivos intracardíacos aumentan un riesgo específico. En ocasiones, un
trombo mural, una comunicación interventricular o
un conducto arterioso permeable pueden
infectarse.
El sustrato básico
para la infección suele ser una vegetación estéril formada por fibrina y
plaquetas, que se desarrolla cuando las células endoteliales lesionadas liberan
factor tisular.
La
endocarditis infecciosa es más frecuente del lado izquierdo (p. ej., válvula
mitral o aórtica). Alrededor del 10 al 20% de los casos compromete las
cavidades cardíacas derechas (válvula tricúspide o pulmonar). Los drogadictos
intravenosos tienen una incidencia mucho mayor de endocarditis del lado derecho
(alrededor del 30 al 70%).
Microorganismos
Los
microorganismos que infectan el endocardio pueden proceder de infecciones
distantes (p. ej., abscesos cutáneos, encías inflamadas o infectadas,
infecciones urinarias) o de sitios de entradas evidentes como un catéter venoso
central o el orificio de punción de una inyección.
Casi
todos los cuerpos extraños implantados (p. ej., derivaciones ventriculares o
peritoneales, prótesis) tienen un riesgo elevado de colonización bacteriana y
de constituirse en el origen de una bacteriemia, y en consecuencia de
endocarditis.
Este
cuadro también puede proceder de una bacteriemia asintomática, como la que se
produce durante procedimientos odontológicos, médicos o quirúrgicos invasivos.
Incluso el cepillado de dientes y la masticación pueden provocar bacteriemia
(en general, por Streptococcus viridans) en pacientes con gingivitis.
Los microorganismos
causantes varían según la localización de la infección, el origen de la bacteriemia
y los factores de riesgo del huésped (p. ej., drogadictos por vía intravenosa),
pero en forma global, los estreptococos y el Staphylococcus aureus causan
entre el 80 y el 90% de los casos.
Los enterococos,
los bacilos gramnegativos, los microorganismos del grupo HACEK (especies
de Haemophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae) y los hongos
causan la mayoría del resto de las endocarditis.
La
enfermedad se desarrolla en 3 estadios:
·
Bacteremia: microorganismos en la sangre
·
Adherencia: el microorganismo se adhiere al endotelio
anormal o dañado a través de adhesinas superficiales
·
Colonización: proliferación del organismo junto con
inflamación, que produce una vegetación madura
Muchos
de los microorganismos causantes producen biopelículas de polisacáridos que los
protegen de las defensas inmunes del huésped e impiden la penetración de
antibióticos
Fisiopatología
La
endocarditis produce consecuencias locales y sistémicas.
Consecuencias locales
Las
consecuencias locales de la endocarditis infecciosa incluyen
·
Abscesos miocárdicos con destrucción del tejido y, en
ocasiones, trastornos del sistema de conducción (en general, con abscesos
septales bajos)
·
Insuficiencia valvular grave súbita, que lleva a
la insuficiencia cardíaca y a la
muerte (en general, debido a lesiones en la válvula mitral o la aórtica)
·
Aortitis como resultado de la diseminación contigua de la
infección
Las
infecciones de las prótesis valvulares tienen grandes probabilidades de estar relacionadas
con abscesos del anillo valvular, vegetaciones que obstruyen el sitio donde se
encuentran, abscesos miocárdicos y aneurismas micóticos manifestados por
obstrucción o dehiscencia valvular y trastornos de la conducción.
Consecuencias sistémicas
Las
consecuencias sistémicas de la endocarditis son sobre todo debido a
·
Embolia de material infectado de la válvula cardíaca
·
Fenómenos inmunomediados (principalmente en
infecciones crónicas)
Las
lesiones en las cavidades cardíacas derechas producen típicamente embolias
pulmonares sépticas, que pueden ocasionar infartos pulmonares, neumonías o
empiemas. Las lesiones de las cavidades cardíacas izquierdas pueden embolizar a
cualquier tejido, en particular a los riñones, el bazo y el sistema nervioso
central. Los aneurismas micóticos se pueden formar en cualquier arteria
principal. Los émbolos cutáneos y retinianos son comunes. Como resultado del
depósito de complejos inmunitarios puede producirse una glomerulonefritis
generalizada.
Clasificación
La
endocarditis infecciosa puede evolucionar de manera lenta y subaguda o en forma
más aguda y fulminante, que se asocia con un riesgo más alto de descompensación
rápida.
La endocarditis bacteriana subaguda, si bien es
agresiva, suele desarrollarse en forma silenciosa y avanzar más lentamente (es
decir, en varias semanas o meses).
A menudo no se
identifica una fuente o una puerta de entrada para la infección. La
endocarditis bacteriana subaguda es producida con mayor frecuencia sólo por
estreptococos (en especial, viridans, microaerófilos, anaerobios, del grupo D
no enterococos y enterococos) y con menor frecuencia por S. aureus, Staphylococcus epidermidis, Gemella morbillorum, Abiotrophia defectiva (antes
denominado, Streptococcus
defectivus), especies de Granulicatella y
especies de Haemophilus con
requerimientos de cultivo especiales.
La endocarditis
bacteriana subaguda se desarrolla con frecuencia en válvulas anormales después
de una bacteriemia asintomática provocada por infecciones periodontales, gastrointestinales
o urogenitales.
La endocarditis bacteriana aguda suele
producirse en forma súbita y avanza con rapidez (es decir, en el transcurso de
varios días). A menudo, se evidencia el origen de la infección o la puerta de
entrada. Cuando las bacterias son virulentas o la exposición bacteriana es
masiva, la endocarditis bacteriana aguda puede afectar válvulas normales. En
general, es secundaria a S.
aureus, estreptococos hemolíticos del grupo A, neumococos o gonococos.
La endocarditis en prótesis valvulares aparece
en el 2 al 3% de los pacientes dentro del año siguiente al reemplazo valvular y
en el 0,5% de los pacientes por año a partir de entonces.
Es mucho más
frecuente después de un reemplazo de la válvula aórtica que de la mitral y
afecta las prótesis valvulares mecánicas y las biológicas en forma equivalente.
Las infecciones más
tempranas (< 2 meses después de la cirugía) se deben
principalmente a la contaminación por bacterias resistentes a los antibióticos
(p. ej., S. epidermidis,
difteroides, bacilos coliformes, especies de Candida, especies de Aspergillus)
durante una operación.
Las infecciones
tardías son el resultado de la contaminación por microorganismos de baja
virulencia durante la operación o de bacteriemias asintomáticas transitorias,
provocadas con mayor frecuencia por estreptococos, S. epidermidis, difteroides y los bacilos gramnegativos con
requerimientos de cultivo especiales incluidos dentro de las especies de Haemophilus, Actinobacillus actinomycetemcomitans y Cardiobacterium hominis.
Signos y síntomas
Los
signos y síntomas varían según la clasificación, pero no son específicos.
Endocarditis bacteriana subaguda
En un principio,
los síntomas de la endocarditis bacteriana subaguda son indefinidos: febrícula
(< 39° C),
sudoración nocturna, cansancio, malestar general y pérdida de peso. El paciente
también puede presentar escalofríos y artralgias. Los signos y síntomas de la
insuficiencia valvular pueden constituir la primera clave. En un primer
momento, ≤ 15% de los pacientes desarrolla fiebre o un
soplo, pero por último casi todos presentan ambos signos.
El examen físico
puede ser normal o incluir palidez, fiebre, cambios en un soplo preexistente o
el desarrollo de un nuevo soplo de insuficiencia y taquicardia.
Las embolias retinianas
pueden producir lesiones retinianas hemorrágicas redondas u ovaladas con
centros pequeños de color blanco (máculas
de Roth). Las manifestaciones cutáneas incluyen petequias (en la parte
superior del tronco, las conjuntivas, las mucosas y la parte distal de los
miembros), nódulos subcutáneos eritematosos dolorosos en las puntas de los
dedos (nodos de Osler), máculas
hemorrágicas indoloras en las palmas o las plantas (lesiones de Janeway) y hemorragias en astilla debajo de las uñas.
Alrededor del 35%
de los pacientes presenta manifestaciones en el sistema nervioso central,
como ataques isquémicos transitorios, accidente
cerebrovascular, encefalopatía tóxica y, si un
aneurisma micótico en el sistema nervioso central se rompe, puede producirse un
absceso encefálico y hemorragia subaracnoidea.
Las embolias
renales pueden causar dolor en el flanco y, rara vez, hematuria macroscópica.
Las embolias esplénicas pueden ocasionar dolor en el cuadrante superior
izquierdo del abdomen. La infección prolongada puede producir esplenomegalia o
hipocratismo digital en las manos y los pies.
Endocarditis bacteriana aguda y endocarditis valvular
protésica
Los síntomas y los
signos de endocarditis bacteriana aguda y endocarditis valvular protésica son
similares a los de la endocarditis bacteriana subaguda, pero la evolución es más
rápida. La primera manifestación suele ser la fiebre y los pacientes
impresionan tóxicos; en ocasiones, se produce un shock séptico.
En alrededor del 50
al 80% de los pacientes, se ausculta un soplo cardíaco en el momento del
diagnóstico, que más adelante puede identificarse finalmente en > 90% de los
casos.
Endocarditis de las cavidades cardíacas derechas
Las embolias
pulmonares sépticas pueden causar tos, dolor torácico pleurítico y, a veces,
hemoptisis. El soplo de la insuficiencia tricuspídea es
característico.
Diagnóstico
·
Hemocultivos
·
Ecocardiografía y, a veces, otras modalidades de
diagnóstico por imágenes
·
Criterios clínicos de DUKE
Dado
que los signos y síntomas son inespecíficos, varían significativamente y pueden
aparecer lenta y gradualmente, para diagnosticar este cuadro el médico debe
tener muy presente la probabilidad.
Debe sospecharse
una endocarditis en pacientes con fiebre sin un origen evidente de la
infección, en particular si se identifica un soplo cardíaco.
En
pacientes con antecedentes de una valvulopatía cardíaca, sometidos
recientemente a ciertos procedimientos invasivos o drogadictos por vía
intravenosa, el hallazgo de un hemocultivo positivo debe sugerir con firmeza
este cuadro. Los pacientes con bacteriemia documentada deben examinarse de
manera exhaustiva y seriada para identificar nuevos soplos y signos de embolia.
Además
de los hemocultivos positivos, la enfermedad no produce otros hallazgos
específicos en las pruebas de laboratorio. Las infecciones suelen causar anemia
normocítica normocrómica, leucocitosis, eritrosedimentación acelerada, niveles
aumentados de inmunoglobulinas, y la presencia de complejos inmunitarios
circulantes y factor reumatoideo, aunque
estos hallazgos no son útiles para confirmar el diagnóstico. A menudo, el
análisis de orina revela hematuria microscópica y, en ocasiones, cilindros
eritrocíticos, piuria o bacteriuria.
Identificación de microorganismos
·
La identificación del microorganismo y su sensibilidad
a los antibióticos resulta fundamental para guiar el tratamiento.
Si se sospecha una endocarditis, deben obtenerse 3
hemocultivos (de 20 mL cada uno) dentro de las primeras 24 horas (si la
presentación sugiere una endocarditis bacteriana aguda, es preciso obtener 2
hemocultivos dentro de las primeras 1 o 2 horas).
Cada
conjunto de cultivos se debe obtener de un sitio de punción venosa separado,
fresco (es decir, no desde catéteres vasculares preexistentes). No es necesario tomar los cultivos durante
los escalofríos o picos febriles porque la mayoría de los pacientes tienen
bacteriemia continua.
En
un paciente con endocarditis que no recibió previamente antibióticos, en
general los 3 hemocultivos son positivos porque la bacteriemia es continua; al
menos 1 hemocultivo es positivo en el 99% de los pacientes.
La
administración prematura de antibióticos en forma empírica debe evitarse en
pacientes con valvulopatías adquiridas o congénitas o con un cortocircuitos
para evitar una endocarditis con cultivos negativos. Si el paciente ya recibió
antibióticos, deben obtenerse hemocultivos, pero los resultados pueden ser
negativos.
Los hemocultivos
pueden tardar entre 3 y 4 semanas para la proliferación de algunos
microorganismos; no obstante, algunos sistemas automáticos de monitorización de
cultivos pueden identificar cultivos positivos en una semana.
Otros
microorganismos (p. ej., especies de Aspergillus) pueden no producir cultivos positivos. Algunos
organismos (p. ej., Coxiella
burnetii, especies de Bartonella, Chlamydia psittaci, especies de Brucella) requieren serodiagnóstico;
otros (p. ej., Legionella
pneumophila) requieren medios de cultivo especiales o PCR (polymerase
chain reaction) (p. ej., Tropheryma
whippelii).
Los resultados
negativos en el hemocultivo pueden indicar una supresión inducida por la
antibioticoterapia previa, una infección por microorganismos que no proliferan
en medios de cultivo convencionales u otro diagnóstico (p. ej., endocarditis no
infecciosa, mixoma auricular asociado con fenómenos embólicos, vasculitis).
Estudios de
diagnóstico por imágenes
En principio debe
solicitarse una ecocardiografía, en general por vía
transtorácica (ETT) en lugar de transesofágica (ETE). La ETE es más sensible
(es decir, con mayor capacidad de identificar vegetaciones demasiado pequeñas
para hallarse en la ecocardiografía trastorácica).
El ecocardiograma transesofágico se debe
realizar cuando
·
Los pacientes tienen una válvula protésica
·
El ecocardiograma transtorácico no es diagnóstico
·
El diagnóstico de endocarditis infecciosa se ha
establecido clínicamente (para detectar perforaciones, abscesos y fístulas)
La TC se usa ocasionalmente cuando
la ETE no define completamente los abscesos paravalvulares y para la detección
de aneurismas micóticos.
La exploración con
tomografía por emisión de positrones (PET) es una herramienta emergente para el
diagnóstico de endocarditis que se origina en dispositivos protésicos e
intracardíacos.
Las anomalías en la
TC y la PET se incluyen ahora como criterios principales en las directrices
europeas.
Criterios
diagnósticos de DUKE
La endocarditis
infecciosa se confirma cuando se identifican microorganismos en el examen
histológico de (o de una muestra de) vegetaciones endocárdicas obtenidas
durante una cirugía cardíaca, una embolectomía o la autopsia. Dado que no suele
ser posible la obtención de vegetaciones para el examen, se desarrollaron
varios criterios clínicos para establecer un diagnóstico.
Incluyen los criterios revisados de Duke (con una
sensibilidad y especificidad > 90%
Los
criterios de Sociedad europea de cardiología (ESC) son similares a los
criterios de Duke modificados, pero incluyen los resultados de imágenes
ampliadas como criterios principales, de la siguiente manera:
·
Vegetación, absceso, seudoaneurisma, fístula
intracardíaca, perforación valvular o aneurisma, o nueva dehiscencia parcial de
la válvula protésica identificada por ecocardiografía
·
Actividad anormal alrededor de una válvula protésica
(implantada > 3 meses antes) detectada mediante PET/TC o single-photon
emission computed tomography (SPECT)/TC con leucocitos radiomarcados
·
Lesiones paravalvulares identificadas por TC cardíaca
El
ESC también difiere de los criterios de Duke menores modificados al especificar
que es suficiente la detección de fenómenos vasculares silenciosos solo
mediante estudios de diagnóstico por imágenes.
______________________________________
Criterios de DUKE
___________________________________
Pronóstico
La endocarditis infecciosa no tratada siempre es
mortal.
Incluso con tratamiento, la muerte es más probable en los adultos mayores y las
personas con
·
Infección por microorganismos resistentes
·
Una enfermedad subyacente
·
Un retraso prolongado en el tratamiento
·
Compromiso de la válvula aórtica o multivalvular
·
Grandes vegetaciones
·
Bacteriemia polimicrobiana
·
Infecciones de válvula protésica
·
Aneurismas micóticos
·
Absceso del anillo de la válvula
·
Eventos embólicos mayores
El shock séptico es más probable
en pacientes con diabetes, insuficiencia renal aguda, infección por S. aureus, tamaño de la vegetación
> 15 mm, y signos de infección persistente.
La tasa de
mortalidad asociada con la endocarditis por Streptococcus viridans sin
complicaciones importantes es < 10%,
pero se aproxima al 100% en la endocarditis por Aspergillus después de una operación en una prótesis
valvular.
El pronóstico es
más favorable en la endocarditis de las cavidades cardíacas derechas que en la
de las cavidades izquierdas porque la disfunción de la válvula tricúspide se
tolera mejor, no se asocia con embolias sistémicas y la endocarditis de las
cavidades derechas por S. aureus responde
mejor al tratamiento antibiótico.
Tratamiento
·
Antibióticos por vía intravenosa (en función del
microorganismo y su susceptibilidad)
·
En ocasiones, desbridamiento, reparación o reemplazo
valvular
·
Evaluación y tratamiento odontológicos (para minimizar
las fuentes orales de bacteriemia)
·
Eliminación de la fuente potencial de bacteriemia (p.
ej., catéteres internos, dispositivos)
El tratamiento
consiste en antibióticos durante un período prolongado.
La cirugía puede
ser necesaria en presencia de complicaciones mecánicas o de microorganismos
resistentes.
Los antibióticos
típicos se administran por vía intravenosa y dado que la duración de la
antibioticoterapia debe extenderse entre 2 y 8 semanas, el tratamiento
ambulatorio suele continuar por vía intravenosa.
Los
orígenes aparentes de la bacteriemia deben tratarse: el tejido necrótico debe
desbridarse, los abscesos deben drenarse y el material extraño y los
dispositivos infectados extirparse.
Las
personas con endocarditis infecciosa deben ser evaluadas por un odontólogo y
tratadas por enfermedades orales que podrían causar bacteriemia y posterior
endocarditis.
Los
catéteres venosos existentes (en particular las vías venosas centrales) deben
cambiarse. Si la endocarditis persiste en un paciente con un catéter venoso
central recién colocado, también debe retirarse ese catéter.
Los
microorganismos dentro de las biopelículas adheridas a catéteres y otros
dispositivos pueden no responder al tratamiento antibiótico y conducir al
fracaso de la terapia o a una recidiva. Si se indican infusiones continuas en
lugar de bolos intermitentes, las infusiones no deben interrumpirse durante
períodos prolongados.
Regímenes
antibióticos
Los fármacos y las
dosis dependen del microorganismo y de su susceptibilidad antibiótica.
Aunque la mayoría de los pacientes son lo
suficientemente estables como para esperar los resultados del cultivo, la
terapia empírica con antibióticos antes de la identificación del microorganismo
puede ser necesaria en pacientes gravemente enfermos.
No se deben
administrar antibióticos hasta que se hayan obtenido hemocultivos adecuados (2
o 3 muestras de diferentes sitios durante 1 hora).
Los antibióticos
deben ser de amplio espectro para cubrir todos los microorganismos probables,
que generalmente incluyen estafilococos, estreptococos y enterococos sensibles
y resistentes.
Los regímenes de
antibióticos empíricos deben reflejar los patrones locales de infección y
resistencia a los antibióticos; sin embargo, los ejemplos típicos de cobertura
antibiótica de amplio espectro pueden incluir
·
Válvulas nativas: vancomicina 15 a 20 mg/kg IV cada 8 a
12 horas (sin exceder 2 g por dosis)
·
Válvula protésica: vancomicina 15 a
20 mg/kg IV cada 8 a 12 horas (sin exceder 2 g por dosis) más gentamicina 1
mg/kg IV cada 8 horas más cefepima 2 g IV cada 8 horas o imipenem 1 g IV cada 6
a 8 horas (dosis máxima 4 g/día)
Tan
pronto como sea posible, el régimen farmacológico empírico debe ajustarse en
función de los resultados del cultivo.
Los drogadictos
intravenosos suelen no cumplir con el tratamiento, emplear las vías para
inyectarse drogas y abandonar el hospital demasiado rápido. En estos pacientes,
puede usarse un tratamiento breve por vía intravenosa o (de segunda elección)
por vía oral.
Para una
endocarditis de las cavidades cardíacas derechas causada por S. aureus sensible a la
meticilina, la indicación de 2 g de nafcilina por vía intravenosa cada 4 horas
sumados a 1 mg/kg de gentamicina por vía intravenosa cada 8 horas durante 2
semanas resulta eficaz, de la misma manera que un régimen de 4 semanas por vía
oral compuesto por 750 mg de ciprofloxacina y 300 mg de rifampicina 2 veces al
día.
La endocarditis de
las cavidades cardíacas izquierdas no responde al tratamiento durante 2
semanas. Para la endocarditis del lado izquierdo, las guías actuales
recomiendan 6 semanas de terapia antibiótica parenteral.
Sin embargo, un
estudio multicéntrico reciente, aleatorizado, no cegado sobre endocarditis
izquierda complicada encontró que el cambio a antibióticos orales (después de
un mínimo de 10 días de terapia parenteral) no fue inferior a la terapia
parenteral continua. Además, la duración de la estancia hospitalaria se acortó
en los pacientes que cambiaron a terapia oral. Este enfoque tiene el potencial
de reducir el estrés psicológico y algunos de los riesgos inherentes a la
terapia parenteral prolongada para pacientes hospitalizados.
Cirugía en las
válvulas cardíacas
La cirugía
(desbridamiento, reparación o reemplazo de la válvula) a veces se requiere para
el tratamiento de la endocarditis infecciosa. La cirugía está indicada en forma
típica en
·
Pacientes con insuficiencia cardíaca (especialmente
aquellos con endocarditis en una válvula nativa o protésica, aórtica o mitral,
y aquellos con edema pulmonar o shock cardiogénico)
·
Pacientes con infección no controlada (aquellos con
infección persistente, infección por hongos o microorganismos resistentes,
endocarditis recurrente con válvula protésica o endocarditis complicada por
bloqueo cardíaco, absceso, aneurisma, fístula o crecimiento de la vegetación)
·
Pacientes en riesgo de embolia (particularmente
aquellos con endocarditis en válvula protésica, aórtica o mitral nativa, y
vegetaciones grandes [definidas en los Estados Unidos como > 10 mm] o
aquellas con émbolos recurrentes)
La determinación
del momento apropiado para la cirugía requiere experiencia clínica. Cuando la
insuficiencia cardíaca secundaria a una lesión corregible se agrava (en
particular producida por S.
aureus, un bacilo gramnegativo o un hongo), puede ser necesaria una
operación después de sólo 24 a 72 horas de tratamiento antibiótico.
En pacientes con válvulas protésicas, se puede
requerir cirugía cuando
·
La ecocardiografía transesofágica muestra dehiscencia
valvular en un absceso paravalvular
·
La disfunción valvular precipita la insuficiencia
cardíaca
·
Se detectan émbolos recurrentes
·
La infección es causada por un microorganismo
resistente a los antibióticos
La endocarditis
de las cavidades cardíacas derechas se suele manejar con
tratamiento médico. Si la cirugía es necesaria (debido a insuficiencia
cardíaca o falta de respuesta terapéutica), entonces se prefiere la reparación
de la válvula antes que su reemplazo para evitar futuras infecciones de la
válvula protésica debido al uso continuo de drogas IV.
La cirugía
generalmente se retrasa un mes después de una hemorragia intracraneal o un
accidente cerebrovascular isquémico mayor.
Respuesta
al tratamiento
Después
del tratamiento inicial, los pacientes con endocarditis estreptocócica
susceptible a la penicilina suelen sentirse mejor y la fiebre suele descender
en 3 a 7 días. La fiebre puede continuar debido a razones diferentes de la
infección persistente (p. ej., alergia a fármacos, flebitis, infarto secundario
a embolia). Los pacientes con endocarditis estafilocócica tienden a responder
más lentamente. La disminución del tamaño de las vegetaciones puede controlarse
con ecocardiografías seriadas. La ecocardiografía debe realizarse al finalizar
la terapia para definir el nuevo estado basal de las válvulas (incluso las
vegetaciones estériles) y la insuficiencia.
Las recidivas suelen producirse dentro de las primeras
4 semanas.
El retratamiento con antibióticos puede ser eficaz, pero en ciertos casos es
necesaria una operación.
En los pacientes
sin prótesis valvulares, el reagravamiento de la endocarditis después de 6
semanas suele ser el resultado de una nueva infección en lugar de una recidiva.
Incluso
después de un tratamiento antibiótico exitoso, pueden producirse embolias
estériles y rotura valvular hasta 1 año más tarde. El riesgo de recurrencia es
significativo, por lo que se recomienda una higiene dental y cutánea continua
durante toda la vida. En los pacientes que requieren terapia con antibióticos
por cualquier motivo se deben extraer al menos 3 conjuntos de hemocultivos
antes de que se inicien los antibióticos.
Prevención
Se
recomienda el examen odontológico preventivo y el tratamiento antes de la
cirugía para reparar las válvulas cardíacas o las cardiopatías congénitas.
Las
medidas para reducir la bacteriemia adquirida en el cuidado de la salud tienen
como objetivo frenar la creciente incidencia de bacteriemia iatrogénica y
posterior endocarditis.
La
higiene dental y cutánea se recomienda para la población general, pero
especialmente para pacientes con riesgo intermedio (con valvulopatía nativa) y
de alto riesgo.
Pacientes de alto riesgo
La American Heart
Association (AHA) recomienda la profilaxis antibiótica en pacientes con
endocarditis infecciosa y riesgo elevado de un resultado desfavorable. Estos
pacientes presentan los siguientes cuadros
·
Válvulas cardíacas protésicas, incluidas las prótesis
implantadas transcatéter
·
Material protésico utilizado para la reparación de la
válvula cardíaca (p. ej., anillos de anuloplastia, cuerdas)
·
Endocarditis infecciosa previa
·
Ciertas cardiopatías congénitas: cardiopatías
congénitas cianóticas no reparadas (incluso cortocircuitos y conductos
paliativos), cardiopatías congénitas sometidas a reparación completa durante
los primeros 6 meses posteriores a la cirugía si se empleó material protésico o
un dispositivo, cardiopatía congénita reparada en la que quedaron defectos
residuales o adyacente al sitio de la reparación
·
Receptores de trasplantes cardíacos con valvuloplastia
Procedimientos que
requieren profilaxis con antibióticos
Los procedimientos
principales que requieren profilaxis en los pacientes con
riesgo elevado son los bucales y los
odontológicos en los que se manipulan las encías o la región periapical de los
dientes o se perfora la mucosa bucal. Otros procedimientos incluyen métodos en
las vías aéreas en los que se realiza una incisión en la mucosa, el parto
vaginal en algunas pacientes de alto riesgo (pacientes con válvula cardíaca
protésica o material protésico utilizado para la reparación de la válvula
cardíaca y pacientes con cardiopatía congénita cianótica no aliviada ni
reparada) y procedimientos gastrointestinales, urogenitales o
musculoesqueléticos que involucran un área con una infección establecida.
Regímenes antibióticos profilácticos
Para la mayoría de
los pacientes y los procedimientos, una sola dosis poco antes del procedimiento
resulta eficaz. En procedimientos bucodentales y respiratorios, debe usarse un
fármaco que actúe contra estreptococos del grupo viridans. Para el parto
vaginal, administre ampicilina 2 g IV o IM más gentamicina 1,5 mg/kg (máximo
120 mg) por vía intravenosa administrada 30 minutos antes del parto, seguida de
ampicilina 1 g IV o IM (o amoxicilina por vía oral) 6 horas después.
En
procedimientos gastrointestinales, urogenitales y musculoesqueléticos en áreas
de tejido infectado, los antibióticos deben seleccionarse en función del
microorganismo documentado y su sensibilidad antibiótica. Si se confirma la
infección pero no se aísla el microorganismo, los antibióticos indicados para
la profilaxis gastrointestinal y urogenital deben ser eficaces contra
enterococos (p. ej., amoxicilina, ampicilina o vancomicina en pacientes
alérgicos a la penicilina).
Los
antibióticos para la profilaxis de la piel y el sistema musculoesquelético
deben ser eficaces contra estafilococos y estreptococos beta-hemolíticos (p.
ej., una cefalosporina, vancomicina o clindamicina si se sospecha una infección
por estafilococos resistentes a la meticilina).
La
endocarditis no infecciosa
Consiste en la
formación de trombos estériles compuestos de plaquetas y fibrina en las
válvulas cardíacas y el endocardio adyacente. En ocasiones, la endocarditis no
infecciosa termina en una infecciosa.
Etiología
Las
vegetaciones no son causadas por una infección. Pueden no detectarse en la
evaluación clínica o constituir un nido para la infección posterior (que genera
a su vez endocarditis infecciosa), producir embolias o comprometer la función
valvular.
Los catéteres que
atraviesan las cavidades cardíacas derechas pueden dañar la válvula tricúspide
y la pulmonar, con adherencia de plaquetas y fibrina al sitio lesionado.
En ciertos
trastornos como el lupus eritematoso sistémico,
los complejos inmunitarios circulantes pueden promover la formación de
vegetaciones friables de fibrina y plaquetas en el área de coaptación de las
valvas (lesiones verrugosas de Libman-Sacks). Estas lesiones no suelen provocar
obstrucción valvular significativa ni insuficiencia.
El síndrome de anticuerpos
antifosfolipídicos (anticoagulantes lúpicos,
trombosis venosas recurrentes, accidente cerebrovascular, abortos espontáneos,
patrón reticular [livedo reticularis]) también puede producir vegetaciones
endocárdicas estériles y embolias sistémicas. Rara vez, una granulomatosis con poliangeítis promueve
al desarrollo de endocarditis no infecciosa.
Endocarditis marántica
En los pacientes
con enfermedades consuntivas crónicas, coagulación intravascular diseminada,
carcinomas metastásicos productores de mucina (p. ej., de pulmón, estómago o
páncreas) o infecciones crónicas (p. ej., tuberculosis, neumonía, osteomielitis), pueden formarse vegetaciones
trombóticas grandes sobre las válvulas y producir embolias significativas hacia
el encéfalo, los riñones, el bazo, el mesenterio, los miembros y las arterias
coronarias.
Estas vegetaciones
tienden a formarse en válvulas cardíacas con malformaciones congénitas o en
aquellas lesionadas por fiebre reumática.
Signos y síntomas
Las
vegetaciones en sí rara vez causan síntomas a menos que su tamaño y su
ubicación causen disfunción valvular, a veces con disnea y/o palpitaciones. Los
síntomas son consecuencia de las embolias y dependen del órgano afectado (p.
ej., encéfalo, riñones, bazo). A menudo, el paciente presenta fiebre y se
ausculta un soplo cardíaco.
Diagnóstico
·
Hemocultivos
·
Ecocardiografía
La endocarditis no
infecciosa debe sospecharse en pacientes con enfermedades crónicas que
presentan síntomas compatibles con una embolia arterial. Deben obtenerse hemocultivos seriados y ecocardiografía. El hallazgo de
hemocultivos negativos y la presencia de vegetaciones valvulares (pero sin un
mixoma auricular) sugieren el diagnóstico. El examen de los fragmentos
embólicos después de la embolectomía puede ayudar a confirmarlo.
La distinción de la endocarditis infecciosa con
cultivo negativo puede ser difícil pero es importante. A menudo, los pacientes
con endocarditis no infecciosa deben recibir un anticoagulante, que está
contraindicado en la endocarditis infecciosa.
Se
deben realizar ensayos para anticuerpos antinucleares y síndrome
antifosfolipídico.
Pronóstico
El
pronóstico suele ser desfavorable, sobre todo debido a la gravedad de las
enfermedades predisponentes y no tanto por la lesión cardíaca.
Tratamiento
·
Anticoagulación
El tratamiento
consiste en anticoagulación con heparina
(sea no fraccionada intravenosa o de bajo peso molecular subcutánea).
Los anticoagulantes orales directos (ACOD) y la
warfarina no se consideran eficaces, aunque no se han llevado a cabo ensayos
comparativos en esta rara afección. Las enfermedades
predisponentes deben tratarse siempre que sea posible.
Habib G,
Lancellotti P, Antunes MJ, et al: 2015 ESC Guidelines for the
management of infective endocarditis: The Task Force for the Management of
Infective Endocarditis of the European Society of Cardiology (ESC). Avalado
por: European Association for Cardio-Thoracic Surgery (EACTS), the European
Association of Nuclear Medicine (EANM). Eur Heart J 36:3075–3123,
2015.
Baddour LM, Wilson
WR, Bayer AS, et al: Infective
endocarditis in adults: Diagnosis, antimicrobial therapy, and management of
complications: A scientific statement for healthcare professionals from the
American Heart Association. Circulation 132:1435–1486, 2015.
Iversen K, Ihlemann N, Gill SU, et al: Partial oral versus intravenous antibiotic treatment
of endocarditis. N Engl J Med 380:415–424, 2019. DOI:
10.1056/NEJMoa1808312
Cahill TJ, Baddour
LM, Habib G, et al: Challenges in
infective endocarditis. J Am Coll Cardiol 69(3):325–344, 2017.
Cahill TJ, Baddour
LM, Habib G, et al: Challenges in
infective endocarditis. J Am Coll Cardiol 69(3):325–344, 2017.
Articulo
extra para revisar:
https://www.medigraphic.com/pdfs/juarez/ju-2017/ju173e.pdf